Diagnose Prostatakrebs: Was jetzt?
Die Diagnose eines Prostatakrebses wird durch eine Gewebeentnahme aus der Prostata mit anschließender Untersuchung unter dem Mikroskop bestimmt. Hierfür werden durch das Ultraschallgerät gesteuert Proben aus der Prostata entnommen (Prostatastanzbiopsie). Dieser Eingriff kann ambulant mit einer örtlichen Betäubung durchgeführt werden. Zum Schutz vor Infektionen sollte vom Tag vor dem Eingriff bis zum Tag danach ein Antibiotikum eingenommen werden.
Wenn mit der Gewebeuntersuchung Krebs in der Prostata nachgewiesen wurde, so ist eine Behandlung notwendig.
Die Säulen der Therapie sind:
- eine kontrollierende Überwachungsstrategie
- die Operation
- verschiedenen Formen der Bestrahlung
- die kontinuierliche oder intermittierende Hormontherapie
- Chemotherapie
- neue Behandlungsmethoden
Welche Art von Behandlung in Frage kommt, ist von vielen objektiven und individuellen Faktoren abhängig. Sie sollten in einem ausführlichen ärztlichen Gespräch erörtert und gegeneinander abgewogen werden. In unseren urologischen Kliniken wird die Therapieplanung interdisziplinär in Zusammenarbeit mit allen Spezialist:innen aus Urologie, Strahlentherapie, Onkologie, Psychologie und Physiotherapie durchgeführt.
Die Behandlung des nicht-metastasierten Prostatakarzinoms
Für Männer mit neu festgestelltem, organbegrenztem Prostatakrebs sind die folgenden Informationen über ihre Erkrankung wichtig für die weitere Behandlung:
- Die Ausdehnung des Tumors (wird durch den Tastbefund der rektalen Untersuchung festgestellt oder ist Ergebnis einer Bildgebung),
- der Aggressivitätsgrad im feingeweblichen Befund der Biopsie (Gleason-Grad),
- die Höhe des PSA-Wertes,
- das zu erwartende Heilungsergebnis der unterschiedlichen Behandlungsmöglichkeiten,
- die möglichen Komplikationen und Nebenwirkungen der einzelnen Therapien,
- der eigene gesundheitliche Zustand, das Alter, bestehende Nebenerkrankungen sowie der eigene Therapiewunsch.
Zur Behandlung des Prostatakarzinoms gibt es viele, teils sehr unterschiedliche Möglichkeiten. Welche Therapie letztlich gewählt wird, ist eine individuelle Entscheidung, die Ärztin:innen und Patient gemeinsam treffen.
Folgende Möglichkeiten werden in der S3-Leitlinie der Fachgesellschaften zur Behandlung eines bösartigen Tumors der Prostata empfohlen [1]:
- aktive Überwachung („Active Surveillance“)
- langfristiges Beobachten („Watchful Waiting“)
- operative Entfernung der Prostata (radikale Prostatektomie)
- Bestrahlung von außen (perkutane Strahlentherapie)
- Bestrahlung von innen (Brachytherapie)
Aktive Überwachung
Durch die Prostatakrebs-Früherkennungsuntersuchungen wird heute auch nicht aggressiver und langsam wachsender Krebs entdeckt, der den Betroffenen nie gesundheitliche Probleme bereitet hätte. Dafür steht das Konzept der aktiven Überwachung, auch „Active Surveillance“ genannt, zur Verfügung. Es verhindert, dass eine sogenannte Überdiagnose zu einer Übertherapie führt und die Männer durch eventuelle Komplikationen einer nicht nötigen Behandlung in ihrer Lebensqualität beeinträchtigt werden.
Für eine aktive Überwachung sollten folgende Kriterien erfüllt sein [4]:
- PSA-Wert kleiner als zehn Nanogramm pro Milliliter (ng/ml)
- Gleason-Score kleiner als sechs
- Tumor ist entweder nicht tastbar oder wenn tastbar, maximal auf die Hälfte eines Prostatalappens begrenzt (T1 bis T2a)
- Tumorzellen in maximal zwei Stanzen bei einer Biopsie mit zehn bis zwölf Stanzen
- weniger oder maximal 50 Prozent Tumorzellen je Stanze
Neben einem niedrigen Risikoprofil des Tumors sollten in der Entscheidung für oder gegen die aktive Überwachung auch das Alter des Patienten sowie eventuell weitere vorliegende Krankheiten („Komorbidität“) berücksichtigt werden. Für Patienten mit fortgeschrittenem Lebensalter oder relevanten Vorerkrankungen ist das auch Konzept des „langfristigen Beobachtens“ („Watchful Waiting“) eine Alternative.
Die aktive Überwachung ist keine Therapie im eigentlichen Sinne. Vielmehr soll durch eine engmaschige Kontrolle des Tumors eine zu frühe oder gar unnötige Behandlung mit operativer Entfernung der Prostata oder Bestrahlung verhindert werden.
Folgende Kontrollintervalle sind vorgesehen:
- In den ersten drei Jahren: vierteljährliche Tastuntersuchung und PSA-Wert Bestimmung sowie jährliche Gewebeprobe.
- MRT-Untersuchungen der Prostata sollen nach individuellem Befundmuster im Rahmen der Kontrolluntersuchungen erfolgen.
- Bei stabilen Werten nach Ablauf des dritten Jahres: halbjährliche Tastuntersuchung und PSA-Wert Bestimmung; Gewebeprobe alle drei Jahre.
Zeigt sich während der Kontrollen, dass der Krebs doch schneller wächst, empfehlen die Leitlinien, die aktive Überwachung zu beenden und eine Therapie zu beginnen.
Welche Nebenwirkungen oder Risiken gibt es?
Das Risiko der aktiven Überwachung liegt darin, dass das Fortschreiten der Erkrankung zu spät erkannt wird. Um dies zu verhindern, wird die oben beschriebene engmaschige Kontrolle des Tumors empfohlen.
Die Studienlage weist zudem darauf hin, dass die aktive Überwachung bei vielen Männern und auch deren Angehörigen zu psychischen Belastungen führen kann. Oft kann eine proaktive Therapie besser verarbeitet werden, als das kontrollierte Abwarten des Krankheitsverlaufs.
Langfristiges Beobachten
Das langfristige Beobachten, auch „Watchful Waiting“ genannt, ähnelt der aktiven Überwachung. Während letztere sich jedoch an jüngere Erkrankte ohne weitere Vorerkrankungen richtet, ist das langfristige Beobachten ein Konzept für ältere Patienten und/oder Patienten mit weiteren schwerwiegenden Erkrankungen. Aufgrund des fortgeschrittenen Alters oder der Vorerkrankungen ist bei dieser Gruppe die Wahrscheinlichkeit höher, dass sie zwar mit, aber nicht an dem Prostatakarzinom sterben.
So finden sich in der feingeweblichen Untersuchung bei rund 70 Prozent der verstorbenen Männer über 70 Jahre Prostatakrebszellen, in der Gruppe der über 90-Jährigen sogar bei rund 90 Prozent [6]. Vor diesem Hintergrund sollte eine Therapie des Tumors mit einer Operation oder einer Bestrahlung aufgrund der möglichen Nebenwirkungen gut abgewogen werden.
Wird bei einem Patienten der oben genannten Gruppe ein langsam wachsendes und wenig aggressives Prostatakarzinom diagnostiziert, kann der Tumor zunächst auch alleinig kontrolliert werden. Eine Therapie wird erst begonnen, wenn der Tumor Beschwerden verursacht. Während eine aktive Überwachung beendet wird, um die Geschwulst selbst zu behandeln, beginnt beim langfristigen Beobachten die medikamentöse Behandlung nur bei auftretenden Beschwerden [1].
Welche Nebenwirkungen oder Risiken gibt es?
Betroffene, die sich für dieses Konzept entscheiden, sollten sich im Klaren darüber sein, dass im Rahmen des langfristigen Beobachtens der lokale Tumor nicht behandelt und damit auch keine Heilung des Prostatakarzinoms angestrebt wird.
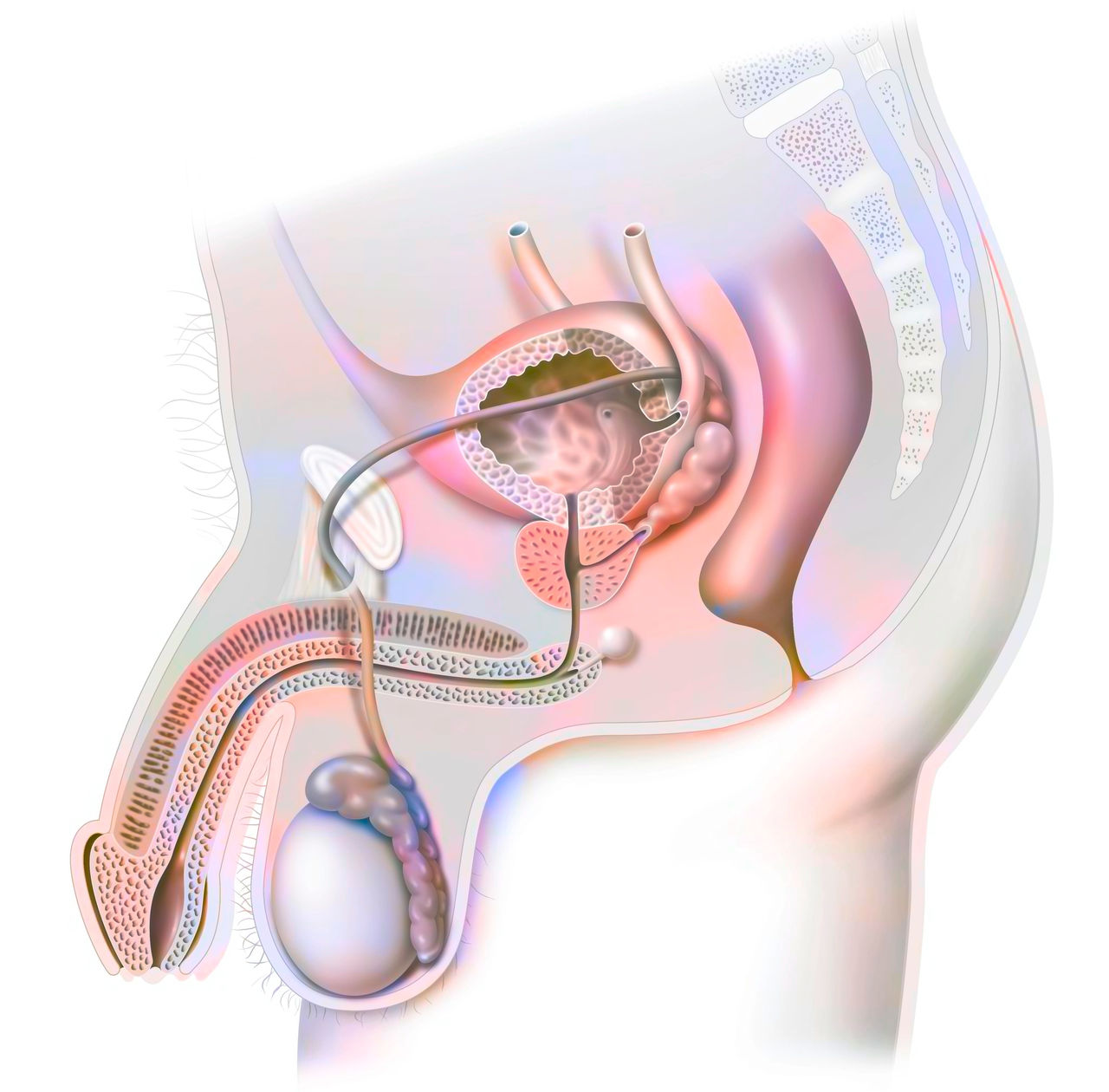
Operative Entfernung der Prostata
Wird die gesamte Prostata mit den Samenblasen entfernt, nennt man dies radikale Prostatektomie (RP). Diese Operation ist der häufigste Eingriff bei einem örtlich begrenzten Krebs der Vorsteherdrüse und wird schon seit mehreren Jahrzehnten angewandt. Eine radikale Prostatektomie ist mit einem mehrtägigen Krankenhausaufenthalt verbunden.
Die radikale Prostatektomie hat zum Ziel, eine nicht-metastasierten Prostatakrebserkrankung zu heilen. Dafür ist es wichtig, die Krebszellen vollständig aus dem Körper zu entfernen. Ob der Tumor komplett entfernt werden konnte oder ob am Schnittrand des Gewebes noch Krebszellen erhalten geblieben sind, gibt der sogenannte Resektionsrandstatus (R-Status) an.
Grundsätzlich kann die radikale Prostatektomie über drei Zugangswege erfolgen:
- von unten, per Schnitt über den Damm
- von oben, per Schnitt über den Unterbauch
- durch minimal kleine Schnitte im Bauchraum („laparoskopisch“ beziehungsweise „extraperitoneoskopisch“)
Neben den verschiedenen Zugangswegen gibt es auch unterschiedliche Operationstechniken:
- Offene Operation: wird meist genutzt, wenn der Zugang über den Schnitt am Unterbauch erfolgt.
- Laparoskopische beziehungsweise extraperitoneoskopische Prostatektomie (minimalinvasive Operation): Bei dieser Operationsmethode werden über minimal kleine Schnitte in der Bauchwand Instrumente sowie eine Kamera in den Körper geschoben, mit deren Hilfe die Prostata operiert wird.
- Roboter-assistierte Operation: Ähnlich wie bei der laparoskopischen beziehungsweise extraperitoneoskopischen Operation werden auch hier Instrumente und Kamera über kleine Schnitte eingeführt, diese werden jedoch nicht direkt von einer Ärztin oder einem Arzt, sondern mithilfe einer Konsole bedient.
Hinsichtlich der Heilungs-und Komplikationsraten sind alle drei Operationsverfahren gleichwertig. Ob der Krebs komplett entfernt werden kann, hängt vor allem vom Können und der Erfahrung der Chirug:innen ab, weniger von der Wahl der Operations-Methode.
Welche Nebenwirkungen oder Risiken gibt es?
Bei rund drei von zehn operierten Männern führt die radikale Prostatektomie nicht zu einer langfristigen Heilung. Bei ihnen tritt später erneut ein Prostatakarzinom auf – entweder am Ort des Ersttumors (lokales Rezidiv) oder in anderen Organen (Metastasen).
Die Prostatektomie kann zudem zu verschiedenen kurz- oder langfristigen Komplikationen führen. Mögliche Komplikationen direkt nach dem Eingriff sind:
- Blutungen
- Verletzungen des Enddarms (Rektum)
- Lungenembolie (Verstopfung eines Blutgefäßes der Lunge durch ein Blutgerinnsel)
- Thrombosen (Verstopfung eines Blutgefäßes durch ein Blutgerinnsel)
Zu den häufigsten langfristigen Nebenwirkungen zählen:
- Erektionsstörungen (erektile Dysfunktion)
- Dick- und Enddarmbeschwerden
- unfreiwilliger Urinverlust (Harninkontinenz)
- Stuhlinkontinenz (bei Zugang über den Damm durch Verletzungen des Enddarms)
- Verengung der Harnröhre (Urethrastriktur)
Perkutane Strahlentherapie
Neben der Entfernung der Prostata ist die Bestrahlung, auch Radiotherapie genannt, die zweite Therapiemöglichkeit, mit der ein nicht-metastasiertes Prostatakarzinom geheilt werden kann. Dabei werden hochenergetische, ionisierende Strahlen genutzt, um entartete Zellen zu schädigen und letztlich abzutöten. Da die Strahlen aber nicht nur Krebszellen schädigen, sondern auch gesunde Zellen, ist es entscheidend, die Dosis im Tumor möglichst hoch und außerhalb des Tumors möglichst niedrig zu halten. Eine sorgfältige Behandlungsplanung durch die Strahlentherapeut:innen ist dafür unerlässlich – sie nimmt oft mehr Zeit in Anspruch, als die Therapie selbst.
Grundsätzlich wird in die Bestrahlung von außen durch die Haut (perkutane Bestrahlung) oder von innen (Brachytherapie) unterschieden. Im Gegensatz zur radikalen Prostatektomie bleibt bei der Strahlentherapie die Prostata erhalten. Somit wird nicht nochmals ein abschließender feingeweblicher Befund erhalten.
Die Strahlentherapie von außen ist eine lange bekannte und erprobte Behandlung. Bei begrenztem Prostatakrebs kann sie als alleinige Therapie eingesetzt werden. Zur Behandlung von fortgeschrittenen Prostatakrebs kann es jedoch auch sinnvoll sein, Operation und Strahlentherapie zu kombinieren und das betroffene Körperareal nach dem Eingriff zu bestrahlen. Diese als „adjuvant“ bezeichnete Strahlentherapie sollte innerhalb von vier Monaten nach der Prostatektomie erfolgen.
Ablauf der perkutanen Strahlentherapie
Für die perkutane Strahlentherapie wird die Prostata von außen mit einem Linearbeschleuniger bestrahlt. Um die unmittelbar benachbarten Organe wie Dickdarm und Harnblase zu schonen, erfolgt die Therapie über circa sechs bis acht Wochen jeweils von Montag bis Freitag mit geringen Einzeldosen. Jede einzelne Bestrahlung dauert dabei nur wenige Minuten. Das Wochenende dient zur Erholung von der Behandlung.
Neue Studien zeigen zwar, dass eine auf vier Wochen verkürzte Strahlentherapie in manchen Tumorstadien gleichwertige Ergebnisse erzielen kann, jedoch sind hierfür etwas höhere Einzeldosen pro Tag nötig (hypofraktionierte Bestrahlung).
Der Erfolg der Behandlung wird durch den PSA-Test kontrolliert. Weitere, aufwändige Untersuchungen sind meist nicht notwendig.
Welche Nebenwirkungen oder Risiken gibt es?
Auch wenn man die Bestrahlung selbst nicht spürt, können im Verlauf der Therapieserie Reizerscheinungen der Harnblase und des Enddarms auftreten, die sich dann als verstärkter Harndrang und erhöhte Stuhlgangfrequenz äußern können. Die meist leichten Beschwerden sollten sich nach Abschluss der Behandlung wieder normalisieren.
Langfristige Nebenwirkungen sind ähnlich denen der radikalen Prostatektomie.
Brachytherapie
Bei der inneren Strahlentherapie, der sogenannten Brachytherapie, wird die Strahlenquelle in die Prostata eingebracht, sodass die Bestrahlung in direkter Nähe zum Krebsgewebe stattfinden kann. Man unterscheidet eine Brachytherapie mit niedriger Dosierung (Low Dose Rate, auch LDR-Brachytherapie oder Seed-Brachytherapie) von der Brachytherapie mit hoher Dosierung (High Dose Rate, auch HDR-Brachytherapie oder Afterloading-Verfahren).
Die LDR-Brachytherapie wird ausschließlich bei Patienten mit niedrigem Risiko empfohlen. Insbesondere Hochrisiko-Prostatakarzinome, die nicht mehr operativ entfernt werden können, aber auch noch keine Metastasen gebildet haben, können mit der HDR-Brachytherapie effektiver bestrahlt werden. Ziel ist, die Geschwulst möglichst stark zu schädigen.
LDR-Brachytherapie
Für die LDR-Brachytherapie werden schwach radioaktive, etwa reiskorngroße Titanstifte („Seeds“) in die Prostata implantiert. Über diese wird eine vorausberechnete Strahlendosis direkt im Organ verabreicht. Dadurch wird das Risiko vermindert, dass gesundes Gewebe oder umliegende Organe verstrahlt werden. Während die Strahlung mit der Zeit abnimmt, verweilen die Titanstifte problemlos in der Prostata.
Die Implantation der Seeds dauert üblicherweise eine bis eineinhalb Stunden. Vor der Operation werden schichtweise Ultraschallbilder von der Prostata gemacht, um den Bestrahlungsplan zu erstellen. Damit stellt man sicher, dass die Seeds dort eingesetzt werden, wo sie benötigt werden. Die Behandlung wird meist unter Vollnarkose durchgeführt. Der Eingriff erfolgt unter Ultraschallkontrolle.
HDR-Brachytherapie
Bei der Brachytherapie im Afterloading-Verfahren (Nachladeverfahren) wird das Tumorgewebe zunächst während eines kleinen Eingriffs mit einigen nicht-strahlenden Führungsapplikatoren wie Schläuchen, Hohlröhren oder Hohlnadeln versehen. Als Strahlenquelle wird Iridium-192 (Gammastrahler) genutzt, das über diese Applikatoren direkt in das Tumorgewebe eingebracht wird. Dort gibt es in genau berechneter Weise Strahlung ab.
So wird eine hohe Strahlendosis im gewünschten Gebiet erzielt und das umgebende gesunde Gewebe geschont. Häufig wird die HDR-Brachytherapie durch eine Bestrahlung von außen mit dem Linearbeschleuniger ergänzt.
Welche Nebenwirkungen oder Risiken gibt es?
Bei der LDR-Brachytherapie kann es nach der Implantation der Titanstifte bei einigen Patienten zu Beschwerden beim Wasserlassen sowie erhöhtem Stuhldrang kommen. Diese Beschwerden sind in der Regel vorübergehend und verschwinden nach ein paar Tagen bis Wochen wieder.
Die HDR-Brachytherapie kann durch die hohe Strahlendosis zu einer Verengung der Harnröhre und daher ebenfalls zu Problemen beim Wasserlassen und erhöhtem Stuhldrang führen.
Da beide Verfahren eine Operation voraussetzen, kann es zudem durch die Narkose zu anästhesiebedingten Nebenwirkungen kommen.
Die Behandlung des metastasierten Prostatakarzinoms
Ist der Krebs über die Prostata hinausgewachsen, kann er mit einer Operation oder Strahlentherapie alleine nicht mehr therapiert werden. Metastasierter Prostatakrebs gilt als nicht heilbar – oft können betroffene Männer aber jahrelang mit der Erkrankung weiterleben. Durch zusätzliche Hormon- oder Chemotherapie kann das Wachstum des Tumors häufig verlangsamt werden.
Hormontherapie
Die Antihormonbehandlung beruht auf der Erkenntnis, dass Prostatakrebs ganz wesentlich vom männlichen Sexualhormon, dem Testosteron, gesteuert und angeregt wird. Ziel ist deswegen, die Produktion des Hormons zu unterbinden (Hormonentzugstherapie) oder die Wirkung des Hormons zu hemmen. 90 Prozent des Testosterons werden in den Hoden gebildet, zehn Prozent in der Nebennierenrinde.
Die Testosteronproduktion im Hoden wird durch Einsatz sogenannter LHRH-Analoga beziehungsweise LHRH-Antagonisten (Depot-Präparate, die subkutan, also unter die Haut, verabreicht werden) blockiert. Um die Vermehrung der Krebszellen noch effektiver zu unterbinden, können Wirkstoffe wie Abirateron, Enzalutamid, Apalutamid und andere zum Einsatz kommen [6].
Die Medikamente aus der Gruppe der sogenannten Antiandrogene werden oral als Tablette verabreicht und sorgen dafür, dass einerseits die Bildung von Testosteron in den Hoden und Nebennieren komplett gestoppt wird (Abiraterone) und andererseits das in der Nebenniere gebildete Testosteron nicht mehr umgesetzt werden kann (Enzalutamid, Apalutamid und andere).
Welche Nebenwirkungen oder Risiken gibt es?
Durch den Hormonentzug können Betroffene trotz der Krebserkrankung oft über Jahre verhältnismäßig beschwerdefrei leben. Da Testosteron jedoch nicht nur die Bildung von Prostatazellen steuert, können auch viele andere Körpervorgänge gestört werden, wenn das Hormon reduziert wird.
Folgende Nebenwirkungen sind möglich:
- Potenz: Verlust der Libido und/oder Erektionsfähigkeit
- Psyche: unter anderem Antriebsschwäche
- Knochen: Abnahme der Knochendichte (Osteoporose)
- Muskulatur: Muskelabbau
- Blutarmut
- Zunahme des Körperfetts und damit Gewichtszunahme
- Brustschmerz und Brustvergrößerung
Chemotherapie
Metastasierter Prostatakrebs kann durch eine Chemotherapie nicht geheilt werden. Jedoch kann sie dazu beitragen, das Tumorwachstum zu verlangsamen und belastende Beschwerden zu verringern.
Da sich Tumorzellen sehr schnell teilen und sich im Falle einer Schädigung nur schwer wieder reparieren lassen, setzt die Chemotherapie auf Medikamente (Zytostatika), die direkt auf das Wachstum von Tumorzellen wirken. Dadurch kann in vielen Fällen eine deutliche Verkleinerung der Tumorzellen erreicht werden.
Männer mit einem metastasierten Tumor erhalten eine auf ihren Allgemeinzustand und die Wachstums- und Metastasierungsgeschwindigkeit des Tumors abgestimmte Therapie, die beim Prostatakarzinom in Ergänzung zur Hormontherapie immer als Einzeltherapie (Monochemotherapie) gegeben werden kann.
Welche Nebenwirkungen oder Risiken gibt es?
Die Chemotherapie greift nicht nur schnell wachsende Krebszellen an, sondern wirkt sich auch auf gesunde, sich schnell teilende Zellen des Körpers, wie etwa Haarwurzelzellen, Zellen des Magen-Darm-Trakts und Geschlechtszellen aus: Haarausfall sowie Übelkeit und Erbrechen können daher auftreten. Auch vermindert eine Chemotherapie unter Umständen die Anzahl an weißen und roten Blutkörperchen im Blut, so dass der Körper gegenüber Infektionen anfälliger wird und das Blutungsrisiko sowie das Risiko einer Blutarmut (Anämie) steigen.
Neue Behandlungsverfahren
In den vergangenen Jahren wurden weitere neue Verfahren zur Behandlung des fortgeschritten metastasierten Prostatakarzinoms entwickelt. So kommen nuklearmedizinische Ansätze, sogenannte Radioligandentherapie, und zunehmend auch auf molekularbiologischer Analyse der Tumorzellen des individuellen Patienten basierende Medikamente (zum Beispiel sogenannte PARP-Inhibitoren) – gegebenenfalls in Kombination mit hochmoderner Immuntherapie – zum Einsatz. Teilweise sind diese neuartigen Methoden derzeit noch alleinig in klinischen Studien verfügbar.
Rezeptbroschüre "Energie- und proteinreiche Zwischenmahlzeiten"
Onkologische Patient:innen verlieren krankheitsbedingt häufig ungewollt an Gewicht und an Muskelmasse, was den Verlauf der Behandlung und Prognose negativ beeinflussen kann. Medizinische Trinknahrung ist ein effektives Mittel um einer Gewichtsabnahme entgegen zu wirken. Leider wird sie nicht immer gut angenommen. Teresa Lorenz, examinierte Diätassistentin am Helios Klinikum Emil von Behring, hat nun in Abstimmung mit Betroffenen eine Broschüre mit Rezepten für energie- und eiweißreiche Zwischenmahlzeiten erstellt.






.jpg/_jcr_content/renditions/cq5dam.web.1280.1280.jpeg)