- Willkommen im Helios Klinikum Erfurt
?qlt=85&ts=1673963304944&dpr=off)

?qlt=85&ts=1673963298085&dpr=off)

Die Helios Kliniken Thüringen Mitte führen in dem Muskuloskelettalen Zentrum als erste Kliniken thüringenweit das Roboterarm-assistierte Mako SmartRobotics™ System am Standort Blankenhain ein.
Als eines von nur zwei Kliniken deutschlandweit wurde unser Fachbereich als "Referenzzentrum für Chirurgische Endoskopie" von der Deutschen Gesellschaft für Allgemein- und Viszeralchirurgie (DGAV) zertifiziert.
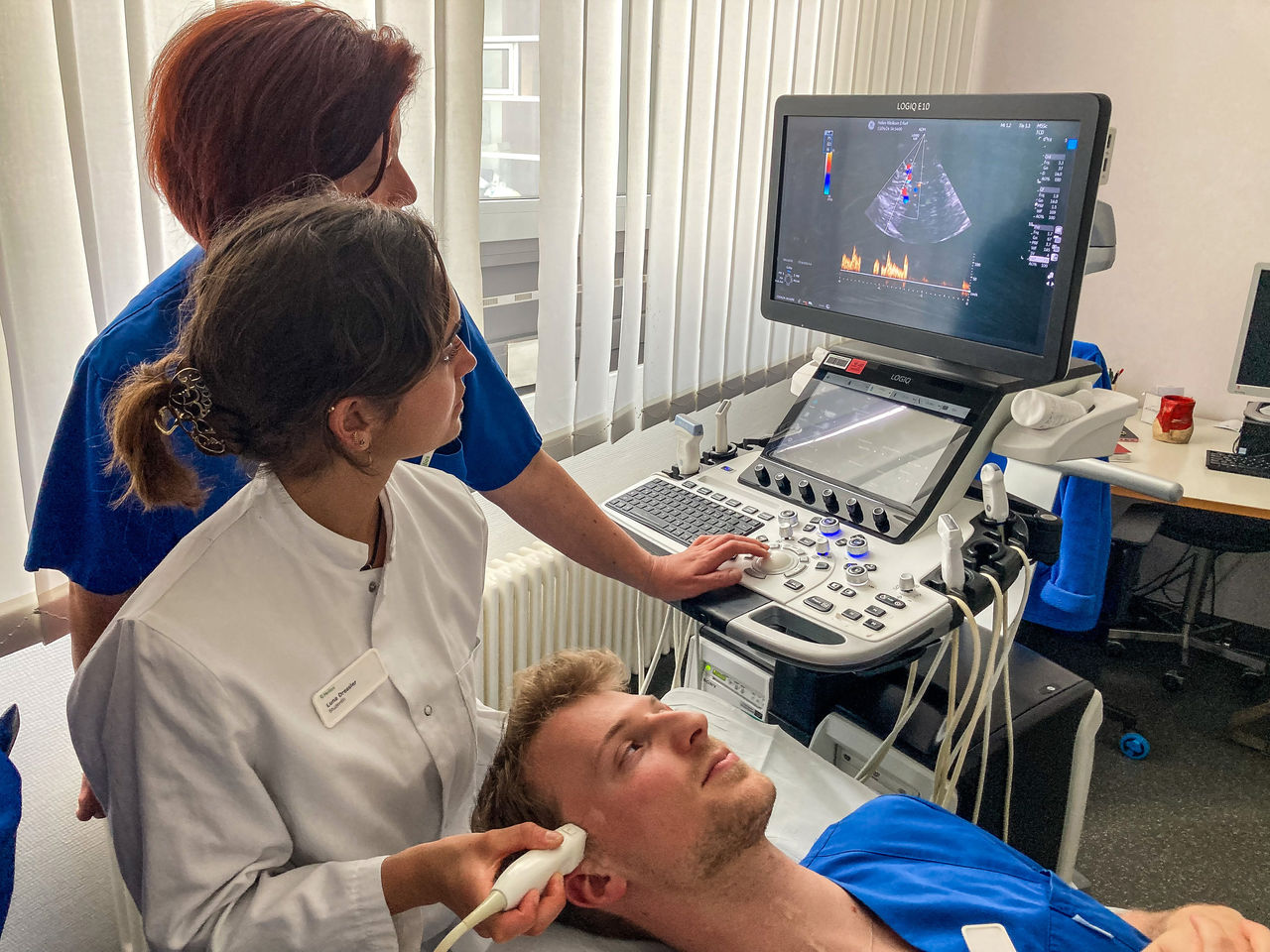
Innovativ, informativ und interdisziplinär beim Thüringer Herztag 2024
Im Foyer des Helios Klinikums Erfurt präsentiert Katrin Steinert für die nächsten zwei Monate ihre Werke.
Inklusion im Fokus: Herzenssachen-Initiative unterstützt die Freiwillige Feuerwehr Elxleben
Priv.-Doz. Dr. med. Jens Martin Kittner übernimmt zum 1. April den Fachbereich Gastroenterologie/Hepatologie, Endokrinologie/Diabetologie und Rheumatologie
Erfurter Sozialpädiatrisches Zentrum mit Qualitätssiegel ausgezeichnet
Attila Dubecz übernimmt die Chefarztposition zum 1. April. Er ist ausgewiesener Experte auf dem Gebiet der robotischen Chirurgie.


?qlt=85&ts=1673963123756&dpr=off)